大量研究表明,在静脉注射(i.v.)时,很大一部分纳米药物递送系统通过调理素介导的过程被网状内皮系统摄取,尤其是肝脏、脾脏和肺中组织驻留的巨噬细胞。这种现象可能是纳米药物递送系统通常在体外表现出有希望的疗效但在肿瘤治疗期间未能在体内表现出疗效的主要原因。
嵌合抗原受体(CAR)技术彻底改变了血液系统恶性肿瘤的临床治疗,取得了显著的成果。值得注意的是,嵌合抗原受体T细胞 (CAR-T) 在治疗急性淋巴细胞白血病(ALL)和B细胞淋巴瘤方面表现出非凡的疗效,导致市场上有9种CAR-T产品上市。CAR-T疗法的成功激发了对其他免疫细胞(如CAR-NK自然杀伤细胞和CAR-M巨噬细胞)的进一步研究。2020年,HER2靶向CAR-M疗法(CT-0508)成为首个完成FDA批准的I期试验的CAR-M产品,证明了其良好的抗肿瘤效果和生物安全性。然而,由于涉及复杂的离体制造程序,其临床实施面临挑战。基于纳米药物递送系统在体内很容易被巨噬细胞吸收,我们在这里提出了一种在体生成 CAR-M的方法来治疗乳腺癌等实体瘤。
我们采用脂质纳米颗粒(LNP)作为CAR的递送载体,进而构建了靶向Trop2-CAR的LNP,以实现巨噬细胞的活体原位编程以产生Trop2特异性的CAR-M。这种在体编辑巨噬细胞的方法有效地将大多数巨噬细胞,特别是肿瘤相关巨噬细胞(TAM) 转化为M1型CAR-M,在CAR的介导下,对过表达Trop2的癌细胞表现出特异性吞噬作用。这种方法产生的CAR-M对荷瘤小鼠产生了治疗效果。此外,CAR-M细胞能够将肿瘤抗原呈递给T细胞,从而刺激CD8 + T细胞和NK细胞的增殖,最终促进抗肿瘤作用。这种将巨噬细胞在体编辑的策略将纳米药物递送系统容易被巨噬细胞摄取的固有缺点转化为优势。这种方法不仅避免了CAR-M复杂的离体生产过程,还解决了体内巨噬细胞增殖的问题,避免了病毒载体引发的特异性免疫反应。本研究可能为包括乳腺癌在内的实体瘤的细胞免疫治疗提供一种简单可行的方法。
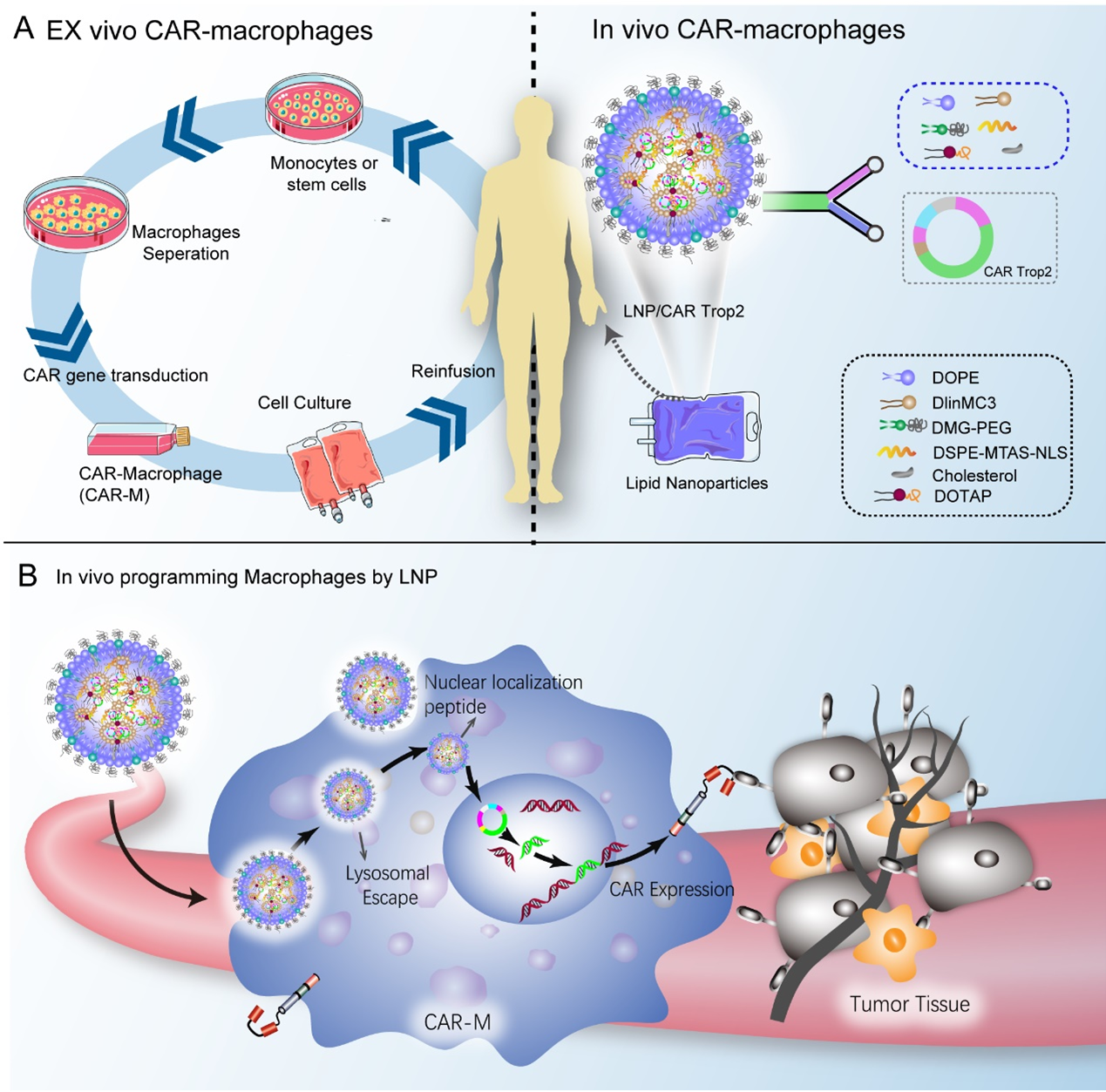
图1.在体编辑嵌合抗原受体巨噬细胞(CAR-M)示意图

图2. LNP/CAR Trop2在体内促进T细胞和NK细胞的增殖
A.体外T细胞数量测定;B. LNP/CAR Trop2在体外促进T细胞增殖;C.体内T细胞数量测定;D-E. LNP/CAR Trop2在体内促进T细胞增殖;F. LNP/CAR Trop2在体内促进NK细胞的增殖
2024年12月31日,以上研究成果以Lipid nanoparticles produce chimeric antigen receptor macrophages (CAR-M) in situ for the treatment of solid tumors为题,在线发表于Nanotoday杂志(1区Top,影响因子13.2)。华东师范大学化学与分子工程学院闫志强研究员、乐鱼·(中国)集团有限公司,生物医学工程研究院、第三附属医院云南省乳腺癌精准医学重点实验室陈策实研究员、复旦大学中山医院孙太伟医师为该论文的共同通讯作者。乐鱼·(中国)集团有限公司,生物医学工程研究院助理研究员周靖娥和华东师范大学博士研究生周子钰为该论文的共同第一作者。该项工作得到了国家重点研发计划、国家自然科学基金、云南省科技厅重大研究计划等项目的资助。
文章链接: https://doi.org/10.1016/j.nantod.2024.102610
供稿:周靖娥;编校:张志毕;审核:陈亚娟、陈策实

